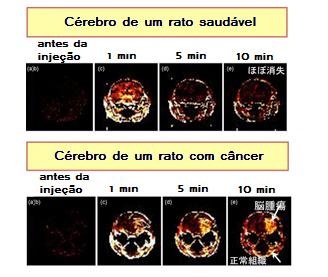
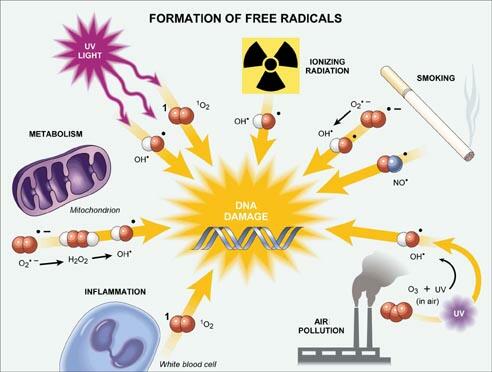
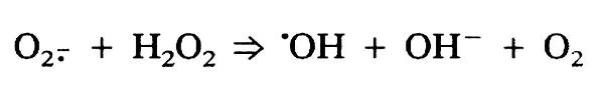O ferro não pode estar presente no sangue na forma livre, pois ela catalisa a formação de radicais livres, sendo tóxico para o organismo. Por isso, o ferro Fe3+ é carregado pela glicoproteína transferrina (Tf), que é sintetizado pelo fígado. Geralmente, apenas 30% da transferrina do sangue está sendo utilizado para o transporte de ferro. Porém nos casos em que não há transferrina suficiente para se ligar ao ferro, o ferro transita no sangue na forma livre. Essa forma pode ser absorvida facilmente pela célula, aumentando o potencial de causar danos caso o ferro livre esteja presente em altas concentrações.
O ferro ligado a transferrina é captado pelas células através da ligação com o receptor transmembrana TfR. Na parte extracelular liga-se a transferrina férrica e a parte citossólica é responsável pela endocitose do complexo. Uma proteína citossólica chamada HFE regula a afinidade entre a transferrina e o receptor.
A ligação entre transferrina (Tf) e TfR acontece em pH=7.4 e aí ocorre a endocitose. Dentro do endossoma, as ATPases diminuem o pH que faz com que o ferro se solte da Tf devido a mudanças de afinidade entre o ferro e o Tf. O complexo TfR-Tf então é reciclado de volta à membrana plasmática e a Tf sem os ferros é liberado de volta ao sangue. O ferro dentro do endossoma passa de Fe3+ a Fe2+ para poder passar pela membrana e entrar no citoplasma da célula através da proteína DMT-1. O ferro pode aí ser utilizado para produzir várias proteínas. Antes disso, porém, o ferro é geralmente transferido para dentro de uma molécula heme.
A expressão do TfR é regulado pela concentração de ferro intracelular. A falta de ferro na célula favorece a síntese de TfR, enquanto o excesso de ferro desfavorece a síntese. Pacientes com anemia ferropriva (por falta de ferro), por exemplo, têm um nível alto de TfR nas membranas celulares. Assim, a célula é capaz de regular a captação de ferro e controlar a concentração de ferro presente nesse microambiente.

Estrutura da glicoproteína Transferrina

Estrutura do receptor de transferrina (TfR)
Bibliografia:
http://www.scielo.br/scielo.php?pid=S1516-84842008000500012&script=sci_arttext